咨询热线
4009688170
【南京中科世康生物科技有限公司】提供专业的服务:动物实验外包,医学整体实验外包服务,Western Blot实验外包等......

一、GST Pull Down
Pull down技术的基本原理是将一种蛋白质固定于某种基质上(如Sepharose),但细胞抽提液经过该基质时,可与该固定蛋白相互作用的配体蛋白被吸附,而没有被吸附的“杂质”则随洗脱液流出。被吸附的蛋白可以通过改变洗脱液或洗脱条件而回收下来。通过pull down技术可以确定已知的蛋白与钓出蛋白或已纯化的相关蛋白间的相互作用关系,从体外转录或翻译体系中检测出蛋白相互作用关系。
为了更有效地利用pull down技术,可以将待纯化的蛋白以融合蛋白的形式表达,即将“诱饵”蛋白与一种易于纯化的配体蛋白相融合。1988年Smith等利用谷胱甘肽-S-转移酶(GST)融合标签从细菌中一步纯化出GST融合蛋白。从此GST融合蛋白在蛋白质相互作用研究领域里得到了极大的推广。GST融合蛋白在经过固定有谷胱甘肽(GSH)的色谱柱时,就可以通过GST与GSH的相互作用而被吸附。当再有细胞抽提物过柱,就可以得到能够与“诱饵”蛋白相互作用的兴趣蛋白。
GST pull down(GST融合蛋白沉降技术)是体外检测蛋白相互作用的常用方法,一般来说,GST融合蛋白pull down方法用于两个方面:一是鉴定能与已知融合蛋白相互作用的未知蛋白质;二是鉴定两个已知蛋白质之间是否存在相互作用。为排除假阳性所设的一组对照实验是在没有诱饵蛋白存在的条件下,将样品结合到GST上。该对照可以是表达有GST(非诱饵融合蛋白)的分别转化细胞裂解物,也可以是将GST加到非转化细胞的裂解物中。设计合适的对照实验非常重要。该方法比较简便,避免了使用同位素等危险物质,在蛋白质相互作用研究中有很广泛的应用。
除了GST以外,类似的融合蛋白很多,如与葡萄球菌蛋白A融合的“诱饵”蛋白可以通过固定有IgG的色谱柱进行纯化;与寡聚组氨酸肽段融合的“诱饵”蛋白可以通过结合Ni2 的色谱柱进行纯化;与二氢叶酸还原酶融合的“诱饵”蛋白可以通过固定有氨甲蝶呤的色谱柱进行纯化等等。
Pull down实验一般用于体外转录或翻译体系,如酵母双杂交系统中检测蛋白质之间的相互作用。但并不能真实的反应蛋白质之间的相互作用,因为在体内它们不一定空间上有碰到,所以并不意味着在生理条件下一定结合。
GST pull down的主要原理是利用DNA重组技术将已知蛋白与GST融合,而融合蛋白通过GST与固化在载体上的GTH(谷胱甘肽)亲和结合。简单来说,我们假定a蛋白和b蛋白可能存在互作,将纯化的融合GST的a蛋白和纯化的b蛋白以及能特异性结合GST的Sephrose 4B beads混合在一起孵育一定时间,然后洗去未结合的蛋白,煮沸beads进行SDS-PAGE电泳。通过Western blot检测结果,我们可以看到GST-a蛋白和b蛋白所对应的条带,即表明了a蛋白和b蛋白因发生相互作用而被GST-a pull down(GST对照只显示一个条带)。
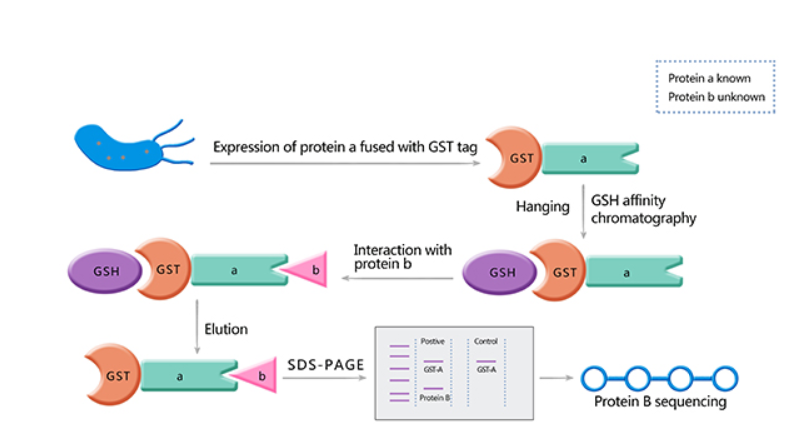
1.GST-a融合蛋白的表达
(1)将目的蛋白与GST的重组质粒转化到BL21菌株中;
(2)挑取单克隆到含有5ml LB培养基(加入5ul氨苄)的10ml试管里,37℃恒温振荡培养箱中培养过夜;
(3)将培养菌液转移到含有500ml LB(含500ul氨苄)的1L锥形瓶中,37℃,200rpm培养数小时;
(4)测定OD600值,当OD600达到0.6左右时,加入适当浓度的IPTG,在20℃,200rpm条件下培养10-16h(通常需要进行预实验以确定最佳IPTG浓度、诱导温度和时间);
(5)诱导适当时间后,将菌液分次倒入50ml离心管中,4℃ 4000rpm离心10分钟,然后弃去上清,收集管底菌体,如暂时不用,可将菌体保存于-80℃冰箱中;
(6)先加入少量PBS于离心管中,离心5-10min后弃去上清,再按每10ml菌液沉淀1ml PBS的量加入相应的PBS,涡旋振荡,使菌体沉淀充分溶解于PBS溶液中;
(7)把混合菌体置于冰水浴中,用超声仪进行破碎。每次超声破碎20s,间隔30s(破碎时间、破碎次数和间隔时间视具体情况而定),经过适当时间超声后,溶液会显得澄清;
(8)将超声后的溶液4℃ 4000rpm离心10分钟,上清液转移至新的离心管中,-80℃保存备用。
2.GST-a融合蛋白的纯化
(1)在新鲜制备的裂解液上清中加入适量体积50% Glutathione Sepharose 4B,4℃摇床上缓慢摇动30~60min;
(2)4℃,4000rpm离心5min,弃去上清,该Sepharose上结合了GST-a融合蛋白;
(3)加入200ul预冷的PBS溶液,轻晃悬浮珠子,将Sepharose洗涤一次,4℃,4000rpm离心5min,弃去上清,重复此步骤3次;
(4)最后一次用移液枪吸走珠子表面的液体,但注意不要吸走珠子,即可获得结合GST-a的Sepharose。
b蛋白可融合His标签进行原核表达,也可融合Flag/HA/Myc等标签进行真核表达。我通常融合His标签进行原核表达。
(1)将结合有GST-a融合蛋白的Sepharose 4B悬浮在适量体积的缓冲液中,加入20ul含有b蛋白的溶液,同时采用结合有GST蛋白的Sepharose作为阴性对照,在摇床上晃动4-8h(4℃);
(2)4℃,4000rpm离心5min,弃去上清液;
(3)沿壁加入200ul预冷的缓冲液对Sepharose进行洗涤,
(4)4℃,4000rpm离心5min,弃上清,该步骤重复3次;
(5)吸干Sepharose上面的液体后,加入20ul 1×蛋白电泳上样缓冲液,沸水浴5min,放入-20℃冰箱备用;
(6)通过SDS-PAGE和Western blot进行检测。
二、DNA pull-down
1.原理概述
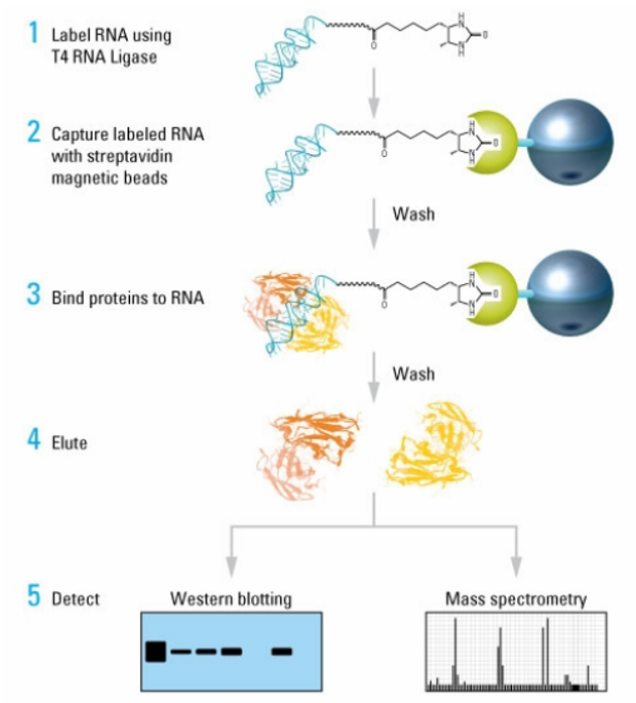
DNA pull-down是体外研究DNA与蛋白互作的有力工具。该技术将生物素标记的DNA片段结合在链霉亲和素磁珠上,再与细胞核蛋白孵育,纯化出与DNA片段互作的蛋白,洗涤洗脱得到的蛋白产物,做western-blot检测特定蛋白是否与靶DNA片段结合;做质谱鉴定即可筛选出与DNA片段可能互作的蛋白信息(如具体某个或某些转录因子/组蛋白等)。
生物素与链霉亲和素间的作用是目前已知强度最高的非共价作用;其中活化生物素可以在蛋白质交联剂的介导下,与已知的几乎所有生物大分子偶联。因此用生物素标记核酸后,可以纯化出与该核酸结合的各种生物大分子复合物。
2.实验流程
DNA pull-down实验首先针对靶标区域设计特异性DNA探针,探针经过脱硫生物素标记,跟偶联在磁珠上的链霉亲和素结合;细胞核提取物与磁珠-DNA探针孵育,作用蛋白质分子可以和DNA探针特异性结合;纯化出与靶DNA片段结合的蛋白复合体,经过洗涤可以将非特异性结合蛋白质去除;最后,经洗脱液洗脱,得到目的DNA探针-蛋白质复合物,再经过Western Blot或质谱(MS)鉴定蛋白质类型。
以下为参考实验流程,不同实验室会有细微差异:
探针设计及标记
(1)采用基因组DNA做模板,经PCR扩增启动子片段;
(2)将其克隆至克隆载体,并测序鉴定成功;
(3)使用PCR法或末端标记法标记探针;
(4)标记的探针利用凝胶回收试剂盒纯化回收探针,并检测探针浓度;
(5) -20℃保存,待用;
Pull down
(1)预先混合 5µg 生物素标记的 DNA 和 500µg 核蛋白,置于冰上;
(2)取 100µl Streptavidin-agarose G 磁珠,用冰冷 PBS 洗一次,5000g 离心 30 秒;
(3)将 DNA 与蛋白的混合物加到磁珠中,重悬磁珠;
(4)4℃孵育 1 小时;
(5)5000g,离心 30 秒,去除上清,收集沉淀;
(6)用冰冷 PBS 洗磁珠三次,5000g 离心 1 分钟,尽可能去除上清,收集沉淀;
(7)加入 30µl 蛋白上样缓冲液,重悬沉淀,沸水煮 10 分钟,
蛋白质检测-- western blot
(1)电泳:实验采用不连续系统蛋白质SDS-PAGE,浓度为5%浓缩胶和8~12%浓度分离胶;每孔上样40~60ug总蛋白,开始电压为100v,到达分离胶后调为120v;
(2)转膜:转膜为恒流转膜,电流为200mA,时间根据目的蛋白分子量选择60~120min。
(3)封闭:蛋白膜放置到TBST溶液中,漂洗1-2分钟,以洗去膜上的转膜液;加入5%脱脂奶粉封闭液,室温50rpm,封闭60分钟。
(4)孵育一抗:根据蛋白Marker指示将PVDF膜剪开,参考一抗浓度;将PVDF膜分别放入含各自一抗溶液中,4度孵育一抗过夜,然后放入TBST洗涤液,摇动洗涤3次,每次15min。
(5)孵育二抗:参考二抗浓度,按比例稀释辣根过氧化物酶(HRP)标记的二抗。将PVDF膜加入稀释好的二抗,室温摇动孵育1h;放入TBST洗涤液,摇动洗涤3次,每次15min。
(6)显色:使用化学发光试剂,黑暗处显色,用X光片压片,显影液及定影液洗片。
蛋白质检测-- MS
(1)切胶:用刀片切取胶粒(胶粒直径1-2mm),置于1.5ml EP管中。
(2)清洗:用200ul MilliQ震荡清洗2次,每次10分钟。
(3)脱色:对于考染胶,加考染胶色液(25mM NH4HCO3, 50% ACN)200ul,37℃ 20分钟或超声脱色5分钟,吸干,重复脱色2-3次,至蓝色褪去。
(4)脱水:加ACN 100ul脱水至胶粒变白,吸弃ACN。
(5)清洗:用200ul MilliQ震荡清洗2次,每次10分钟;然后用200ul 50% ACN震荡清洗2次,每次10分钟。
(6)脱水:加ACN 100ul 脱水至胶粒变白,吸弃ACN。
(7)用25mM NH4HCO3稀释Trypsin 至12.5mg/ml,每管加10ul,稍微离心一下,让酶液与胶粒充分接触,4℃放置30min ,待酶液被胶粒完全吸收,吸弃多余的酶液,加25mM NH4HCO3 20ul,37℃过夜(16h)。
(8)质谱样品使用德国Bruker公司的Ultraflex III质谱仪开展分析,参数设置:反射模式;
(9)离子源加速电压1为24kv;
(10)加速电压2为22kv;
(11)离子延迟提取0.000ns;
(12)真空度1.4×10-7 Torr;
(13)质谱信号单次扫描累加200次;
(14)使用标准Maker峰作为外标校正质谱峰,正离子谱测定,测定范围控制在700-4000;
(15)样品的肽质量指纹图谱,胰酶自降解峰和污染物质的峰自动剔除;
(16)利用LIFT软件将PMF强度最大的5个峰进行串级质谱分析(峰强度大于300)。
3.DNA-pull dwon模式图如下所示:
4.结果示意图:
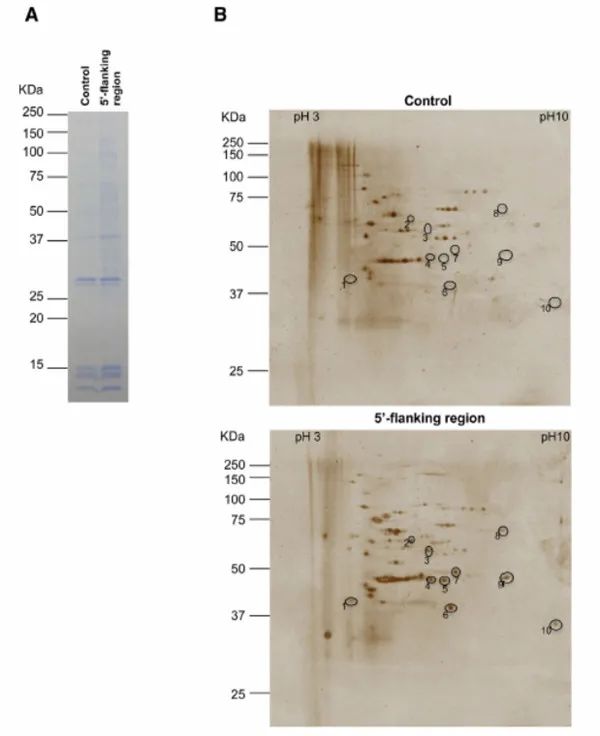
跟RNA pull-down很像,就是RNA换成了DNA,检测的对象就变成了DNA与蛋白的互做。那么它有哪些应用呢?
5.技术应用
核酸与蛋白质的互作是细胞功能的核心,包括蛋白质合成、mRNA组装等生命活动中重要的代谢过程,研究核酸与蛋白质的互作是研究生命科学的基本工具。DNA pull-down主要用于目的DNA片段的互作蛋白(如转录因子等)筛选。
具体沟通:400-9688-170
增值服务
组织/切片服务
各类病理染色服务
免疫组织化学(IHC)实验服务
western blot(wb)实验服务
动物各类疾病模型服务
动物活体成像实验服务
动物微型CT成像实验服务
动物核磁共振(MRI)成像实验服务
动物超声成像实验服务
分子及蛋白实验检测服务
透射电镜(TEM)实验服务
细胞培养实验服务
细胞造模实验服务
细胞毒性检测服务
慢病毒、腺病毒、载体构建
南京中科世康生物公司,长期致力于医学科研实验、快速检测一站式技术服务,是一家整体实验外包的专业服务机构。我们有上百种动物疾病模型、活体成像、高通量测序、病理病毒、流式周期,透射电镜,PCR、Western Blot、ELISA检测等等,实验人员拥有十年的实战经验,跟多个高校、医院老师合作,期待您的咨询~ 4009688170